القانون الثاني للديناميكا الحرارية هو أحد القوانين الرئيسية الأربعة الخاصة بـ الترموديناميك “thermodynamics”، والتي تُعد فرعًا من فروع الفيزياء ذات الصلة بالعلاقات والتحولات التي تحدث بين الطاقة الحرارية ومختلف أشكال الطاقة الأخرى ومدى تأثير ذلك على المادة، وفي السطور التالية توضيح لـ ملخص القانون الثاني للديناميكا الحرارية وأهم تطبيقاته وما يتعلق به من مسائل ومخالفات
محتويات
قوانين الديناميكا الحرارية
تزامن أول ظهورٍ للدراسات الخاصة بالديناميكا الحرارية مع اختراع الآلة البخارية في القرن التاسع عشر، حيث القوانين والمبادئ التي يتم قياسها وملاحظتها من خلال التجارب، والآن أصبح هناك أربع قوانين رئيسية يبدأ نظام الترقيم فيها من الصفر على النحو التالي
القانون صفر للديناميكا الحرارية
القانون الأول للديناميكا الحرارية
القانون الثاني للديناميكا الحرارية
القانون الثالث للديناميكا الحرارية
وكل قانون منها يصف سلوكيات محددة لعملية انتقال الحرارة، أما فيما يتعلق بتعريف تطبيقات القانون الثاني للديناميكا الحرارية، فهذا ما سوف يتم شرحه لاحقًا بشكل مبسط
مفهوم الإنتروبي
هو مفهومٌ هام ضمن مفاهيم الديناميكا الحرارية، وقد بدأنا بتعريفه حتى يتسنى لنا فهم القانون الثاني للديناميكا الحرارية وتطبيقاته والذي ينص على أن “أي تغيّر يحدث تلقائيًّا في نظامٍ فيزيائي، لا بد وأن يصحبه ازديادٌ في مقدار “إنتروبيته”، فما هو الإنتروبي؟
يرمز لـ الإنتروبي “entropy” بالرمز “S” وهو مقياسٌ لدرجة الفوضى أو العشوائية بين الجسيمات المكونة للنظام سواء كانت ذرات أو جزيئات أو أيونات، وبالتالي قياس تشتت الطاقة المصاحبة لهذه الجسيمات، وكلما كانت العشوائية أكبر كلما زادت قيمة الإنتروبي والذي يقاس بوحدة جول لكل كلفن (J/K)
القانون الثاني للديناميكا الحرارية
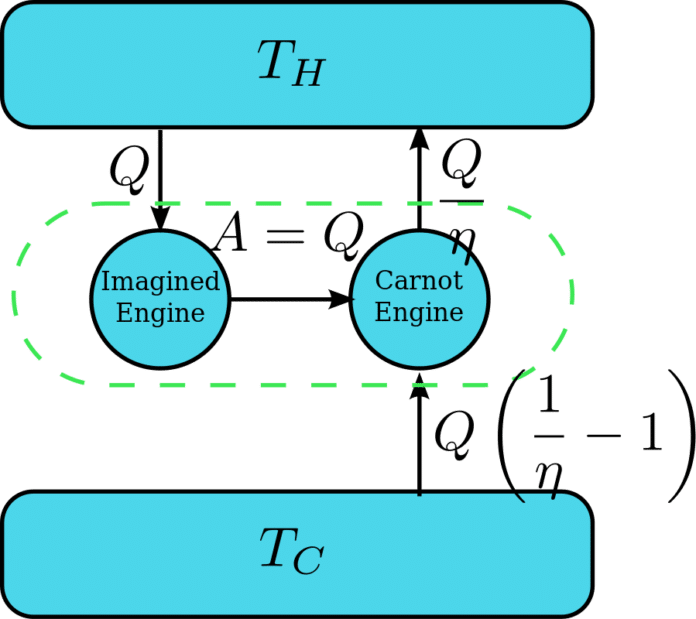
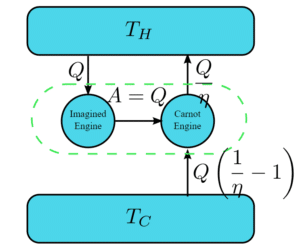
ظهر أول تعريف حول هذا القانون في عام 1824 حيث أوضح العالم الفرنسي “كارنو” أثناء اختراع محركه “أن هناك حدًّا أعلى لكفاءةِ تحويل الحرارة إلى شغل في محرك حراري”
وبعد إجراء الكثير من الدراسات والتجارب ذات الصلة نصَّ القانون الثاني للديناميكا الحرارية على أن أي تغيير يحدث في نظام فيزيائي مغلق لابد وأن يصاحبه ازدياد في مقدار إنتروبيته، ولنضرب مثالًا مبسطًا لفهم هذا القانون فنتخيل صندوقًا يحتوي على أغراض خاصة بك ولكنه غير مرتب “تشير فوضوية الصندوق هنا إلى الإنتروبي” ويشير الصندوق ذاته إلى “النظام المعزول”، ووفقًا للقانون فإنه كلما زادت الفوضى في الصندوق كلما زادت قيمة الإنتروبي، والعكس صحيح، ويعدُّ الجهد المبذول لتنظيم الصندوق بمثابة تدخل خارجي على النظام المعزول، والذي يؤدي بدوره إلى زيادةٍ في قيمة الإنتروبي خارج الصندوق لتتجاوز القيمة المفقودة داخله
وبطريقةٍ أخرى، يمكننا القول أن ملخص القانون الثاني للديناميكا الحرارية يرتبط مع الاتجاه الطبيعي للعمليات في الأجسام والتي تسير في اتجاه واحد غير انعكاسي، ومثال ذلك أن الحرارة تسير بشكلٍ تلقائي من الجسم الساخن إلى الجسم البارد وليس العكس إلا إذا أثر عليها شغل خارجي على النظام، ومثال ذلك “الثلاجة” والتي تنتقل فيها الحرارة من البارد إلى الساخن من خلال استخدام شغل خارجي، وهذا هو ما عبر عنه العالم الألماني “كلازيوس” في عام 1850
مسائل وتطبيقات القانون الثاني للديناميكا الحرارية
يمكننا توظيف فوائد تطبيقات القانون الثاني للديناميكا الحرارية في تقنية التبريد، حيث يتم استخدامها في تقليل متطلبات الطاقة اللازمة لتسييل الهواء والهيليوم، وكذلك يتم استخدامها في تخزين طاقة المغناطيس فائقة التوصيل، تخزين ونقل الهيدروجين السائل، وتخزين الغاز الطبيعي المُسال
وفيما يلي أهم تطبيقات القانون الثاني للديناميكا الحرارية التي نستخدمها في حياتنا اليومية
- أجهزة الثلاجات والتي تنتقل فيها درجات الحرارة المنخفضة إلى درجات حرارة أعلى من خلال توفير نظام خارجي يعمل على التخلص من الحرارة الموجودة في الأطعمة داخل الثلاجة
- جهاز مكيف الهواء، والذي يعمل على خفض درجة حرارة المكان والحفاظ على انخفاضها لفترات
- المدفأة، حيث تعمل على امتصاص درجة الحرارة من الجو وتوفيرها في المكان البارد
وزيادةً في التوضيح، فإن هناك عددًا من المقولات التي يمكن أن نستنتج منها مسائل على القانون الثاني للديناميكا الحرارية، ومن أهمها
- من غير الممكن بناء آلة تعمل بحركة أبدية دون تزويدها بطاقة خارجية
- لا يوجد تغير تلقائي للحالة بحيث يستطيع نقل حرارة من جسم بارد إلى جسم ساخن
- العمليات التي تتم من تلقاء نفسها تسمى عمليات غير عكوسة
- كل العمليات التي تحدث في الطبيعة هي عمليات من النوع غير العكوس
لماذا نحتاج إلى القانون الثاني للديناميكا الحرارية وتطبيقاته؟

ينص القانون الأول للديناميكا الحرارية على الحفاظ على الطاقة، ولكن هناك العديد من العمليات التي يمكننا تخيلها للحفاظ على الطاقة ولكن لا يُلاحظ حدوثها في الطبيعة، ومثال ذلك في حالة وضع جسم ساخن على جسم بارد ، تنتقل الحرارة من الجسم الأكثر سخونة إلى الجسم الأكثر برودة، ولا يحدث العكس بشكل تلقائي، بمعنى آخر، إذا تركت الحرارة الجسم الأكثر برودة وانتقلت إلى الجسم الأكثر سخونة ، فلا يزال من الممكن الحفاظ على الطاقة. ومع ذلك فإن هذا لا يحدث بشكل تلقائي، لذا كان من الضروري وجود القانون الثاني للديناميكا الحرارية ليفسر هذه الظواهر التي لا تحدث بشكل تلقائي، ولنستفيد من تطبيقاتها في حياتنا اليومية
في برادفورد نقدم الكثير من المقالات والمواضيع التي نغطيها بشروحات وتفاصيل كاملة يمكنك تصفح المزبد من المحتوى